衛福部研發技術成果快訊--解鎖精準:預測 EGFR-TKI 療效之免疫組織化學染色測試法
2025-10-08技術名稱
解鎖精準:預測 EGFR-TKI 療效之免疫組織化學染色測試法
執行團隊 /
- 國立臺灣大學醫學院附設醫院新竹臺大分院病理部 黃賢能 主治醫師/主任
- 財團法人國家衛生研究院癌症研究所 李家惠 博士/副研究員
技術摘要
在當前精準醫療的浪潮中,癌症標靶治療的挑戰已不再僅限於找出「對的基因突變」,更在於如何預測哪些病患「真正會受益」,才能落實「在對的時間,給對的藥」之精準治療。EGFR酪胺酸激酶抑制劑(EGFR-TKI)為非小細胞肺癌(NSCLC)、頭頸癌…等癌種帶來突破性進展,但即使是帶有EGFR突變的患者,對藥物反應仍有高度差異,不僅影響臨床治療結果,延誤改善治療策略,也造成健保與社會資源的重大壓力。為了因應這項未被滿足的臨床需求,我們團隊研發出一項以LDOC1蛋白為標的之免疫組織化學染色(IHC)檢測套組,作為一項輔助診斷工具,以精準預測病患對EGFR-TKI治療的反應性,作為醫師在決定是否施以EGFR-TKI標靶治療前的重要依據。
技術內容
臨床研究驗證:精準預測EGFR-TKI治療後的癌症進程與存活率
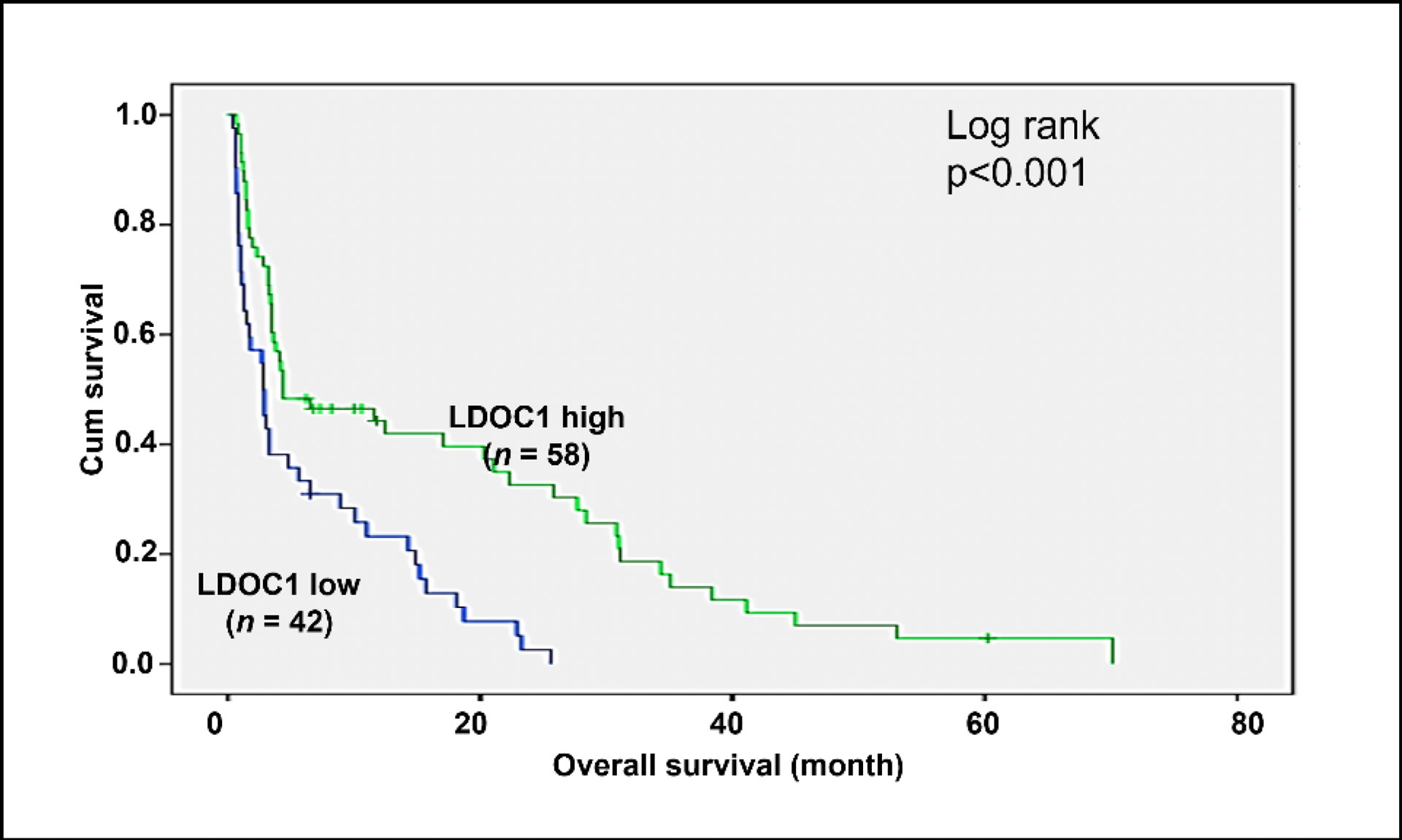
我們已完成一個回溯型臨床資料分析:針對100位接受第一代EGFR-TKI(gefitinib)治療的EGFR突變型晚期肺腺癌病患之腫瘤組織,進行LDOC1表現量的IHC染色分析,並依其表現量高低分為LDOC1高表達組(n = 58)與LDOC1低表達組(n = 42),分析其治療後五年間的腫瘤進程與存活率,結果顯示:
- LDOC1蛋白表達量與病患之總生存期高度相關聯:LDOC1高表達組生存率明顯高於低表達者(P < 0.001)(圖一)
- LDOC1蛋白表達量高組較晚發生腫瘤惡化:高表達組平均13.8個月,明顯優於低表達組6.2個月(表一)
- LDOC1蛋白表達量高組短期快速惡化風險降低:三個月內疾病惡化者,高表達組僅26%,遠低於低表達組60%(表一)
這些結果充分證實了LDOC1檢測的臨床效用,具精準預測力與分層潛力。
分子機制探討:揭示LDOC1與EGFR-TKI反應的關鍵連結
在機制研究中,我們發現LDOC1參與調控EGFR與其他酪胺酸激酶型受體的內化與降解路徑。當LDOC1缺失時,EGFR雖內化,但未被正常降解,反而異常累積於細胞質且持續活化(圖二),因此降低EGFR突變型肺腺癌細胞對EGFR-TKI的敏感度;相對地,LDOC1足量表達的情況下,EGFR傾向細胞膜位(圖二),對EGFR-TKI的敏感度佳(圖三)。事實上,LDOC1還透過很多其他機轉的運作影響EGFR-TKI毒殺癌細胞的效能,LDOC1缺失的EGFR突變型肺腺癌細胞不僅對第一代EGFR-TKI(gefitinib)之敏感度大幅降低,對第二代EGFR-TKI(erlotinib)也如此。這些結果不僅解釋了臨床觀察到的治療後存活率之差異,也提供了EGFR-TKI標靶治療失敗的分子機制,部分內容已發表於國際期刊(註一)。
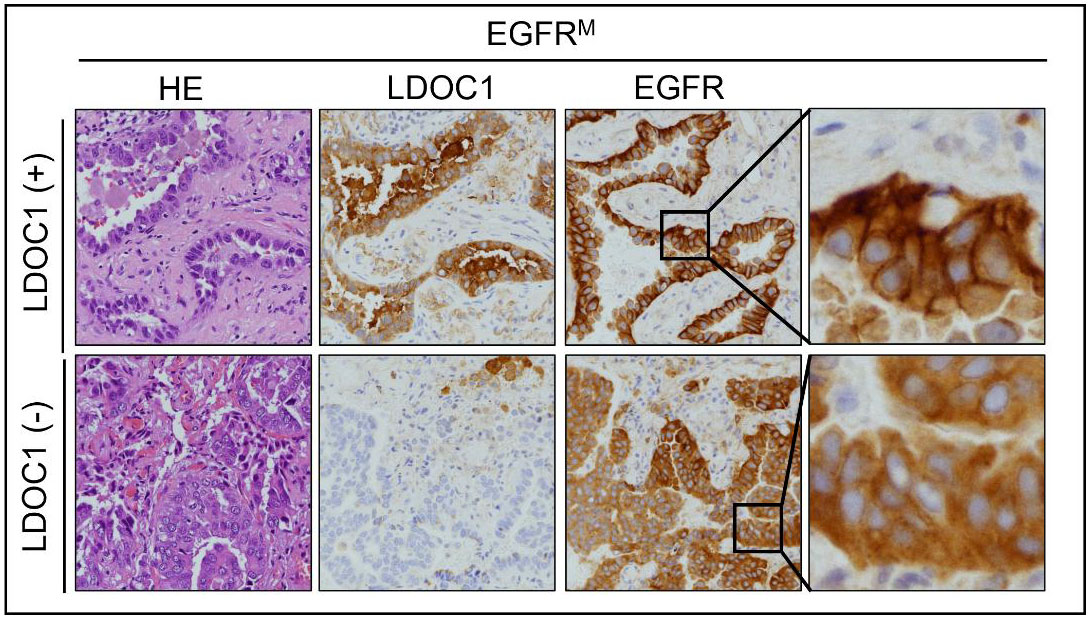
圖二、當LDOC1缺失時,EGFR雖內化,但未被正常降解,反而異常累積於細胞質且持續活化,因此降低細胞對EGFR-TKI的敏感度。
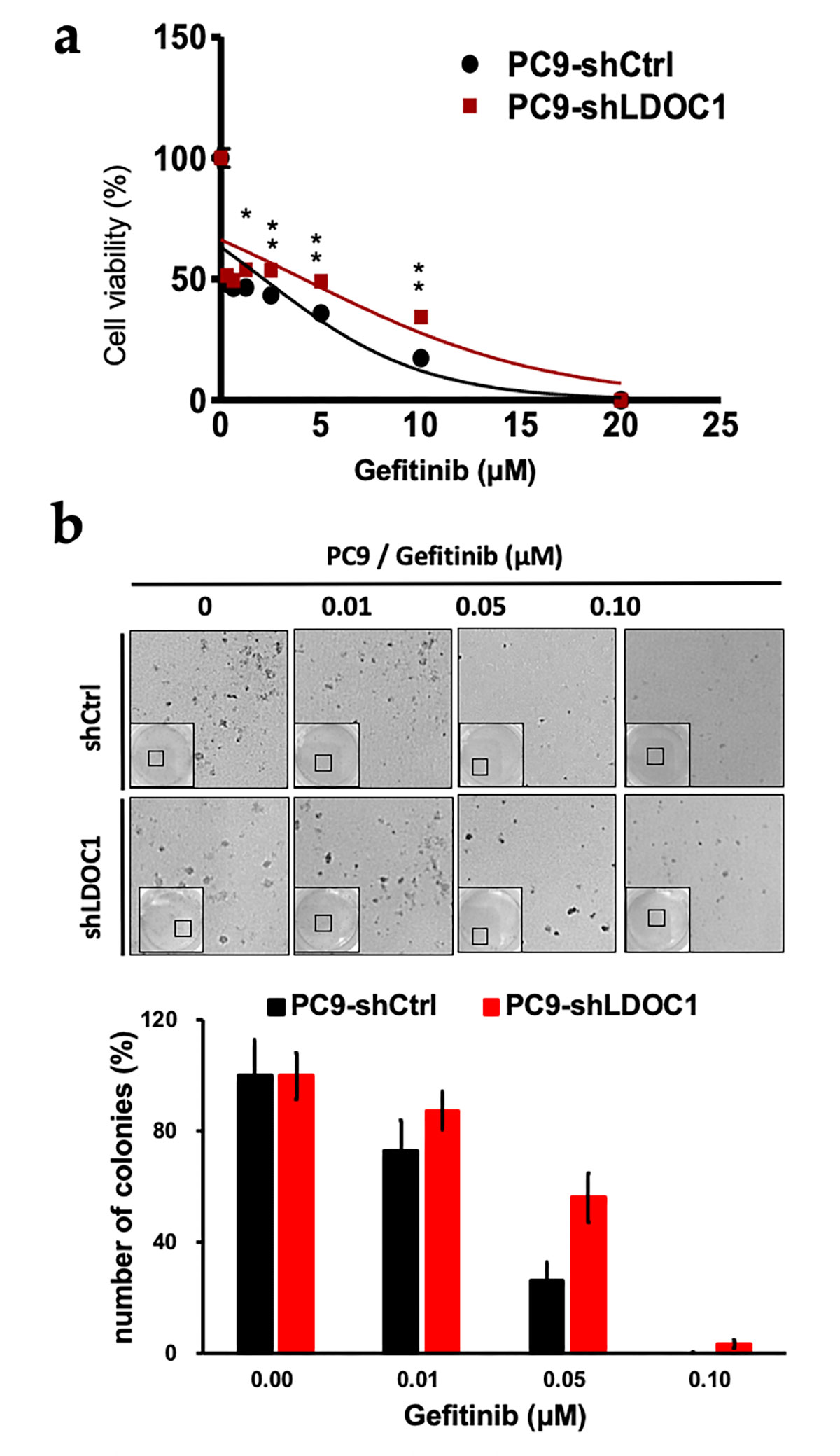
圖三、LDOC1足量表達的EGFR突變型肺腺癌細胞(PC9-shCtrl),對EGFR-TKI的敏感度顯著優於 LDOC1缺失的細胞(PC9-shLDOC1)。
臨床建議:以LDOC1 IHC測試作為EGFR突變檢測後的第二層篩選機制,輔助診斷EGFR突變型非小細胞肺癌病患是否施用EGFR-TKI治療
完整流程如下:
- 以基因檢測篩選出EGFR突變者
- 對於EGFR突變型患者進行LDOC1 IHC檢測
- LDOC1高表現者為EGFR-TKI反應者,建議使用EGFR-TKI治療(反應佳)
- LDOC1低表現者為EGFR-TKI無反應者,建議考慮替代方案,如免疫療法、質子或重粒子治療等。
以LDOC1 IHC檢測做為第二層篩檢可避免醫治時間延誤與醫療資源浪費。
應用場域擴展:潛力不只肺癌病患
雖然開發過程主要使用肺腺癌細胞株與檢體進行研究,然而EGFR的過度活化與高度表達現象已在多種惡性腫瘤中被觀察到。此外,許多抗藥性腫瘤亦呈現EGFR過度表達及活化,因此本檢測未來具跨癌別應用潛力,市場可觀。本測試套組除了可作為EGFR-TKI反應性判斷依據外,亦可應用於臨床試驗,篩選適合的臨床試驗參與者以提高成功率。此外,亦可作為壽險公司用以調整客戶保費之依據及健保用藥資格事前篩選標準。
精準醫療與健保改革的接軌
隨著社會邁入高齡時代,台灣健保體系正面臨癌藥快速成長的財務壓力,近十年癌藥費用平均年成長率達10.2%。以2022年為例,癌症藥物總支出達392億元,占藥費16.9%,而EGFR-TKI等標靶藥物支出占癌藥61.7%。現行的健保給付制度(國人若被診斷出是EGFR突變型的晚期肺癌病患,健保即全額補助第一代EGFR-TKI治療)可以解釋為何EGFR-TKI等標靶藥物造成如此龐大的健保費用支出,但又難以達成預期的功效−肺癌的五年存活率仍僅19.7%,亦即五年死亡率達80.3%,高居台灣十大癌症之冠,而它也是花費最多健保支出的癌症。肺腺癌為肺癌中佔比最多者,且亞洲肺腺癌病患有高達60%為EGFR突變者。假如以LDOC1 IHC檢測套組作為決定是否進行EGFR-TKI治療前的重要評估,不僅可使醫師對於不適用EGFR-TKI的病患即時選擇更佳治療策略,亦可大幅降低健保支出。
創新成果與技術亮點
本研發案之創新成果與技術亮點歸納簡述如下:
- 檢測標的創新性:現有 EGFR-TKI 輔助診斷多針對 EGFR 基因突變(exon 19 deletion、L858R、T790M 等)進行 DNA 檢測,本產品首次導入蛋白層級生物標誌。
- 大幅提升EGFR-TKI用藥精準度:為 EGFR 突變型非小細胞肺癌提供第二層檢測,克服單靠EGFR突變狀態決策治療的限制。已完成的回溯性臨床資料分析結果顯示”LDOC1蛋白表現量與病患接受EGFR-TKI gefitinib治療後的存活率高度相關(n =100, P < 0.001)”。此臨床數據支持”LDOC1 IHC測試可精準分群病患是否適合接受EGFR-TKI治療。
- 將致力於AI導入IHC圖像判讀,使此測試套組發展為數位診斷模式。。
- 安全、簡便:以既有的病理檢體即可執行,屬伴隨性檢測,無須再額外採收檢體。
- 成本低、技術門檻低,可搭配病理室已有的自動IHC染色儀、圖像判讀系統,無需大規模設備升級,適合醫學中心與地區醫院快速導入。
結語:實現精準醫療與資源永續的雙重價值
我們開發的LDOC1 IHC檢測套組,整合分子機制、臨床驗證與應用策略,不僅具高度科學性與臨床意義,更契合政策端對「實證導向」、「成本效益」與「精準醫學」的期待。這是一項醫病雙贏、政策可行、商業可擴展的創新成果。
未來,我們將持續拓展LDOC1 IHC測試套組在其他癌種的應用,並推動與藥廠、保險業者與健保單位的跨領域合作,真正實現讓精準醫療落地的願景。
團隊簡介或技術聯絡人
如需合作試用、技術轉移、商業推廣或健保試辦案討論,歡迎聯絡:
李家惠 博士
國家衛生研究院 / 癌症研究所 副研究員
E-mail:chlee124@nhri.edu.tw
電話:037-206166 #31740
黃賢能 主治醫師/主任
國立臺灣大學醫學院附設醫院新竹臺大分院/病理部 主治醫師/主任
E-mail:ken102huang@gmail.com